 11.05.2016, 11:32
11.05.2016, 11:32
|
#1 (permalink)
|
|
Kullanıcıların profil bilgileri misafirlere kapatılmıştır.
|  Çarpışma Kuramı Nedir? Çarpışma Kuramı Nedir?
Çarpışma Kuramı Nedir?
kuram, çarpışma, çarpışma kuramı, çarpışma kuramı hakkında bilgiler
ÇARPIŞMA KURAMI (TEORİSİ)
Çarpışma kuramı, tepkimeleri tanecik düzeyinde açıklar. Tepkimeye giren atom, iyon veya molekül birbirleriyle çarpışmadığı (birbirinden uzakta olduğu) sürece bir kimyasal tepkime olmaz. Bu tanecikler tepkime vermesi için birbirleriyle mutlaka çarpışmalıdır.
Örnek olarak:  ve ve 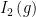 moleküllerinden HI(g) molekülleri oluşabilmesi için; moleküllerinden HI(g) molekülleri oluşabilmesi için;

I. Tepkimeye giren  ve ve 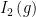 moleküllerinin çarpışması, moleküllerinin çarpışması,
II. Tepkimeye giren  ve ve 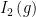 da aynı tür atomlar arasındaki bağların kopması. da aynı tür atomlar arasındaki bağların kopması.
III. Ürünlerde (hidrojen ile iyot arasında) yeni bağların oluşması gereklidir.
Bunun için de (bir tepkimenin olması için):
1- Taneciklerin uygun geometride çarpışmaları.
2- Çarpışan taneciklerin tepkime için minimum kinetik (eşik enerjisine) enerjiye sahip olmaları gereklidir.
HI ün oluşumu aşağıda şematik olarak gösterilmiştir.
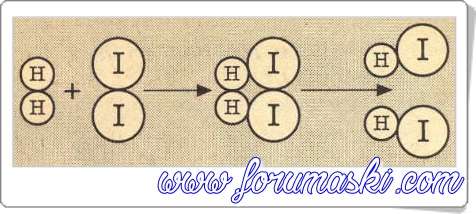

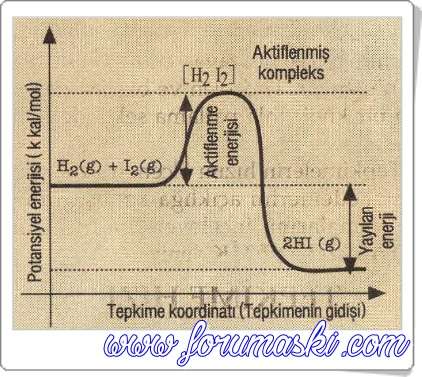
Tepkimeye Aktifleşmiş ürünler giren maddeler kompleks HI ün oluşumunu grafik üzerinde gösterebiliriz.
►Aktifleşme (Etkinleşme) enerjisi: Tepkimeye giren maddelerin
 potansiyel enerjisi ile aktiflenmiş (etkinleşmiş) kompleksin (H2I2 nün) potansiyel enerjisi arasındaki farktır. Ea simgesi ile gösterilir. potansiyel enerjisi ile aktiflenmiş (etkinleşmiş) kompleksin (H2I2 nün) potansiyel enerjisi arasındaki farktır. Ea simgesi ile gösterilir.
►Bir kimyasal tepkime de, tepkimenin başlayabilmesi için gerekli minumum enerjiyi (eşik) kinetik enerji yönünden aşan tanecik (molekül, atom veya iyon) sayısı ne kadar çok ise tepkime o derece hızlıdır.
Örnek olarak verilen aşağıdaki iki şekilden II. sinde I. sine göre daha fazla molekül, eşik enerjisini aşmıştır.
Aktiflenmiş kompleks iki şekilde bozunabilir.
1- Aktiflenmiş kompleksden tepkimeye giren maddeler tekrar oluşabilir. Bu durumda tepkime olmaz. Aktiflenme enerjisi, tepkimeye giren maddelerin kinetik enerjisi şeklinde ortaya çıkar. Örnek olarak; oluşan  aktiflenmiş kompleksin tekrar aktiflenmiş kompleksin tekrar 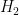 ve ve 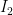 ye dönmesi. ye dönmesi.
2- Aktiflenmiş kompleks ürünler vererek bozunabilir. Bu durumda aktiflenme enerjisi, ürünlerin kinetik enerjisi olarak açığa çıkar. Soğurulan enerji ile açığa çıkan enerji arasındaki fark, TEPKİME ISISINI verir. Basınç sabit olduğunda entalpi değişimini verecektir.
Tepkime ısısı:
ΔH=İleri tepkimenin Eai — Geri tepkimenin Eag
►ΔH <0 ise tepkime ekzotermiktir.
(Çevresine ısı verir.)
►ΔH>0 ise tepkime endotermiktir.
(Çevresinden ısı alır.)
►Tersinir bir kimyasal tepkime (geri dönüşebilen) bir yönde ekzotermik ise geri yönde endotermiktir.
►Tersinir bir tepkimenin endotermik yönündeki aktiflenme enerjisi ekzotermik yönündeki aktiflenme enerjisinden daha büyüktür.
Örnek olarak HI ün elementlerinden oluşma ve elementlerine ayrışmasıyla ilgili enerji-tepkimenin gidişi şeklini inceleyelim.
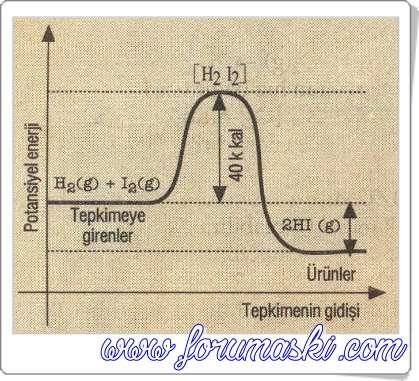
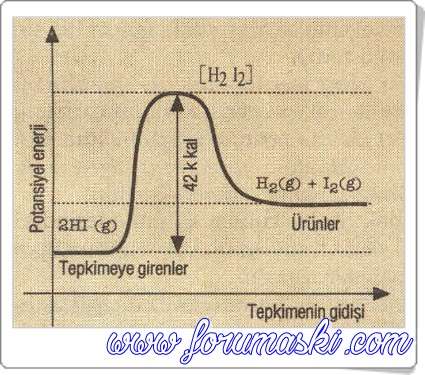
HI ün elementlerinden oluşması I. şekilde görüldüğü gibi ekzotermik bir tepkimedir.
Aktiflenme enerjisi (Eai) = 40 k.kal dir.
HI ün elementlerine ayrışma tepkimesi II. şekilde görüldüğü gibi endotermik bir tepkimedir.
Aktiflenme enerjisi (Eag) = 42 k.kal dir.
► Ekzotermik tepkimelerde aktiflenme enerjisinin tamamı tepkime sonunda çevreye verilir. Endotermik tepkimelerde ise aktiflenme enerjisinin tamamı tepkime sonunda çevreye verilmez. Bir kısmı oluşan ürünlerin yapısında depolanır.
I. şekilde (Ekzotermik tepkimede) ki tepkime ısısı (ΔH):
ΔH = İleri yöndeki Eai + geri yöndeki Eag
ΔH = 40-42 – – 2 k.kal dir.
II. şekilde (Endotermik tepkimede) ki tepkime ısısı (AH):
ΔH = İleri yöndeki Eai – geri yöndeki Eag
ΔH = 42-40 = 2 k.kal dir
|
 |  |